Los injertos de piel representan una alternativa muy interesante para la promoción de la cicatrización de heridas crónicas recalcitrantes a pesar de un adecuado manejo convencional. Uso la palabra interesante porque se trata de una terapia que, bien realizada, puede ser muy eficiente y, además, es un campo en el que se está investigando e innovando. Los próximos post estarán dedicados a las diferentes técnicas de obtención de injertos cutáneos, un campo que me apasiona. Hablaremos especialmente de los microinjertos, que es la que utilizo normalmente en la consulta. Sin embargo, para que esta terapia tenga éxito, es esencial un buen uso de la misma. El objetivo del algoritmo que encontraréis a continuación es situar el tratamiento con injertos cutáneos dentro del continuum de manejo de las úlceras crónicas. Espero que os resulte útil.
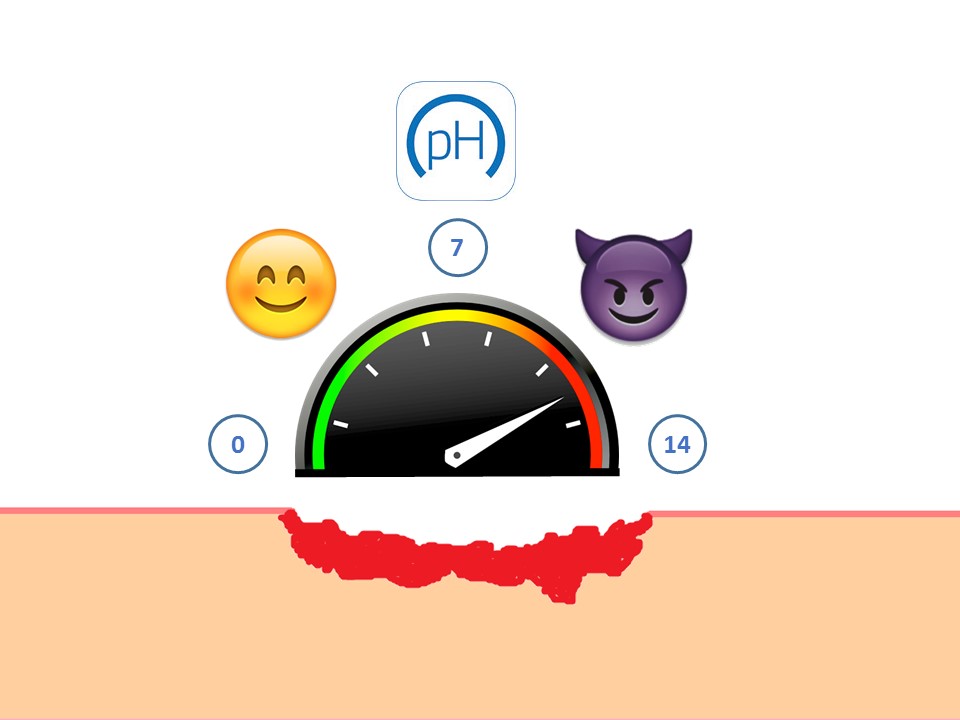
El interés del pH en la cicatrización de las heridas
A pesar de que no sea algo en lo que pensemos o midamos en nuestra práctica clínica diaria, mantener un pH adecuado en el lecho de la herida es esencial para la promoción de la cicatrización. ¿Cuál es el pH óptimo y por qué? Vamos a descubrirlo.
¿Qué es el pH?
El pH es una medida de la concentración de iones hidrógeno (H+). Esta medida se hace en una escala logarítmica con un rango de 0-14. La concentración de H+ en los diferentes fluidos del organismo es crítica, ya que pequeños cambios en la misma pueden alterar el equilibrio de reacciones químicas.
Un pH de 7 se considera neutro. Si la concentración de H+ aumenta, el pH es inferior a 7 y se denomina ácido. Si la concentración disminuye, el pH será superior a 7 y se considerará básico.
En el organismo existen diferentes sistemas, denominados tampón, que estabilizan el pH tisular. Entre ellos las proteínas, que unen y liberan iones H+ para que se mantenga el equilibrio.
El pH natural de la piel es ácido y su rango es 4-5,5. El mantenimiento de este pH es esencial para preservar el equilibrio de la flora cutánea y evitar la proliferación de patógenos. En geles, jabones y productos de cosmética se emplea la denominación pH neutro para referirse a que su pH se acerca al fisiológico de la piel, lo que puede llevar a error.
¿Cómo influye el pH en una herida?
El proceso de cicatrización necesita desarrollarse en un microambiente adecuado, en el que influyen diferentes factores intrínsecos y extrínsecos. Entre los primeros está el pH, del que dependen funciones esenciales como:
- la liberación de oxígeno
- la angiogénesis
- la actividad proteasa
- la toxicidad bacteriana.
La liberación del oxígeno en los tejidos no sólo depende de la perfusión, sino también de la difusión. Para promover la cicatrización de una úlcera crónica es esencial que la tensión tisular de O2 (pO2) sea elevada (>40mmHg). Una disminución del pH de 0,9 unidades puede aumentar 5 veces la difusion de oxígeno.
Las proteinasas (ver post Las metaloproteinasas en las heridas crónicas: el problema de una actividad destructiva descontrolada) son enzimas que destruyen la matriz celular y los factores de crecimiento esenciales para la cicatrización. Estas enzimas tienen una actividad máxima con pH neutro o alcalino, en función de la proteinasa. Estas enzimas las produce la propia herida, pero también las liberan las bacterias que se encuentran en la misma.
Por otro lado, las bacterias también producen amonio a partir de la acción de la ureasa sobre la urea, con la consiguiente toxicidad y alcalinización del microambiente.
¿Cuál es el pH óptimo para la cicatrización?
Los estudios que han medido el pH de las heridas crónicas han detectado un rango entre 7.15–8.9. Se ha demostrado que las heridas con pH más alcalino tienen unas tasas de curación inferiores a las que tienen un pH cercano a 7. Cuando el proceso de curación comienza a progresar adecuadamente, el pH de va haciendo neutro y, posteriormente, ácido. Se piensa que el pH de no depende de la profundidad de la herida, sino del tipo de tejido que exista en el lecho.
¿Qué interés tiene el pH en nuestra práctica clínica?
Se ha demostrado que la oclusión de las heridas reduce la pérdida de dióxido de carbono (CO2), lo que impide que se produzca una alcalosis en el lecho. Se han realizado estudios con diferentes apósitos bioactivos que confirman que disminuyen el pH de la herida.
Actualmente la evaluación de la evolución de una herida se basa en hallazgos y criterios subjetivos. El registro del pH en el lecho de la úlcera podría representar un método objetivo útil para determinar si el tratamiento empleado está promoviendo la cicatrización.
Para la monitorización del pH, las tiras de papel tornasol, por su baja especificidad, no son un método adecuado. Ha de utilizarse pH-metro, que es un sensor con electrodo que realiza la medición mediante un método electroquímico. Lamentablemente, habitualmente no disponemos de este aparato en la consulta. Todo se andará.
Si quieres profundizar sobre el tema, aquí te dejo la revisión más completa que he encontrado: The significance of surface pH in chronic wounds
El arte de lavar las heridas
Todos tenemos interiorizado que la limpieza es esencial en el manejo de las heridas y siempre es la primera acción cuando realizamos una cura. Pero, ¿Realmente hay que lavar siempre las heridas? ¿Qué es lo mejor para lavar las heridas? ¿El suero salino, el agua del grifo? ¿Qué utilizas tú normalmente? Vamos a ver lo que se ha estudiado al respecto.
¿El lavado de la herida siempre es esencial?
El exudado de las heridas, sobre todo en las agudas, es una fuente de factores de crecimiento y de otras sustancias bioactivas que promueven la cicatrización. Estudios que han comparado la limpieza de estas heridas con la ausencia de la misma, no encuentran diferencias significativas con respecto a la sobreinfección o la tasa de cicatrización.1 Por otro lado, un lavado indiscriminado puede dañar el tejido frágil neoformado del lecho. Por lo tanto, la limpieza en cualquier herida ha de ir dirigida a eliminar lo que está dificultando su cicatrización, que no siempre es sencillo de identificar.
¿Suero salino o agua del grifo?
Al hacer esta revisión, me ha llamado la atención la escasez de estudios robustos que se han realizado para establecer cuál es la mejor solución limpiadora. Ésta debe ser un fluido que ayude a retirar el exceso de exudado y el tejido desvitalizado, sin resultar tóxica para el microambiente del lecho de la herida. Tradicionalmente se utilizaban los antisépticos clásicos (clorhexidina, povidona yodada). Sin embargo, dado que se ha mostrado su toxicidad celular y consecuente enlentecimiento de la cicatrización, actualmente su uso está totalmente desaconsejado en las guías de práctica clínica. En esta categoría no se debería incluir a la nueva generación de productos con propiedades antisépticas que no alteran el proceso de cicatrización, como la polihexanida, cuyo uso es beneficioso en heridas recalcitrantes con biofilm resistente.
Recientemente se ha realizado una revisión sistemática que concluye que el agua de grifo potable puede ser tan eficaz y más eficiente (por su menor coste) que el agua estéril o el suero salino. Se incluyeron 7 ensayos clínicos que comparaban las tasas de infección y de curación al comparar el uso de agua del grifo y suero salino y no se detectaron diferencias estadísticamente significativas en heridas agudas y crónicas.1
¿Cuáles son las propiedades de cada uno?
El suero salino al 0.9% es una solución isotónica, por tanto no altera los fluidos del lecho de la herida, no dificulta la cicatrización, no produce daño tisular, causa alergia o altera la flora bacteriana normal.
El agua se ha empleado durante años, objetivándose beneficio de su uso. El agua es una solución hipotónica, así que una irrigación mantenida en el tiempo o frecuente estimularía la absorción de líquido por ósmosis, con el consiguiente aumento del edema y ruptura celular. Esto produciría un incremento del exudado y una necesidad de mayor número de cambios de apósito. Sin embargo, mientras que la limpieza no implique hacer una inmersión de la herida en agua durante tiempo prolongado, su uso habitual en la limpieza de las heridas no es dañina y además es fácilmente accesible y eficiente.2 En países con menos recursos y difícil acceso al agua potable, una alternativa es el uso de agua hervida o destilada.
Otro punto muy interesante: ¿Cuál es la temperatura óptima a la que debe estarla solución limpiadora?
La temperatura óptima de la superficie corporal para el proceso de cicatrización está en el rango de 33 a 42ºC. Fuera de estos límites, la cicatrización se retarda.
En cada cambio de apósito, disminuye la temperatura del lecho de la herida, con la consiguiente inhibición de la actividad mitótica. La recuperación de la temperatura normal puede tardar 40 minutos, mientras que el reinicio de la mitosis puede tener lugar hasta 3 horas después.
Se ha demostrado que las soluciones limpiadoras usadas a temperatura ambiente pueden disminuir 2ºC la temperatura del lecho, y por tanto esta resultaría inferior a 33ºC. Por lo tanto, en la práctica, lo ideal sería calentar el agua o el suero al menos hasta 37ºC y que la limpieza sea rápida para evitar la caída de temperatura.3
Referencias:
Dermatosis pustulosa y erosiva de piernas: posiblemente hayas visto algún caso sin saberlo
La dermatosis pustulosa y erosiva de las piernas es una patología que en muchos casos no se diagnostica por desconocimiento de su existencia. ¿Habías oído hablar alguna vez de ella? Probablemente que, después de la lectura de este post, se te venga a la cabeza algún caso que se podría encuadrar en este diagnóstico. Vamos allá.
¿Qué es la dermatosis pustulosa y erosiva de piernas?
Se trata de una entidad inflamatoria de origen desconocido. La primera descripción la realizó Laningan en 1987.1 Desde entonces, se han publicado casos aislados y algunas series cortas.2 Su incidencia está infraestimada ya que el diagnóstico no suele hacerse por desconocimiento de la entidad. La dermatosis pustulosa y erosiva también puede aparecer en el cuero cabelludo.
Suele aparecer en mujeres de edad avanzada. A pesar de que a veces puedan verse pústulas no foliculares, de tamaño variable y consistencia friable, lo normal es que predominen las erosiones, con o sin costras. Es frecuente que se presente en contexto de insuficiencia venosa crónica. La afectación puede ser uni o bilateral, sobre todo en la cara anterior del tercio medio de piernas. Las lesiones son indoloras y el prurito no es frecuente. El curso es progresivo y no remite de manera espontánea. El hecho de que en la mayoría de los casos no observemos las pústulas puede dificultar el reconocimiento de esta dermatosis.2,3
¿Por qué se produce?
La etiopatogenia no está clara. Se incluiría en el espectro de las enfermedades inflamatorias. Algunos autores la consideran una dermatosis neutrofílica.
Entre los posibles factores predisponentes se incluye :
- Atrofia cutánea por fotoenvejecimiento
- Insuficiencia venosa crónica
- Inflamación crónica cutánea
- Heridas (úlceras, zona de injerto o donante del mismo, quemaduras, traumatismos)
- Oclusión con vendas o apósitos
- Carencia de zinc, vitamina C
En esta foto se observan erosiones cubiertas por costra en una zona donante para injerto (intervención realizada 1 año antes). El paciente refería que el cuadro había comenzado 15 días antes con la aparición de pústulas.
¿Cómo se diagnostica?
Al realizar una biopsia, podemos observar erosiones, pústulas subcórneas y un infiltrado inflamatorio dérmico inespecífico. En caso de observarse pústulas, éstas no son foliculares (diferencia con una foliculitis bacteriana). Normalmente no existen signos de vasculitis y no se observan bacterias ni hongos.1
Los resultados de los cultivos son negativos.
Como hemos visto, los hallazgos histológicos que se obtienen no son específicos, pero ayudan para descartar otras patologías (inflamatorias, infecciosas o tumorales) que pueden tener una presentación clínica similar:2
- Dermatitis de contacto irritativa o alérgica
- Dermatitis por desencadenante externo (físico o químico)
- Eccema de estasis
- Erosiones secundarias al exceso de exudado
- Foliculitis bacteriana
- Psoriasis pustulosa
- Piodermitis vegetante. Se produce por abscesos superficiales debidos a estafilococos o estreptococos
- Pioderma gangrenoso granulomatoso superficial. Se trata de erosiones con borde sobreelevado. En la biopsia se observa un infiltrado neutrofílico
- Penfigoide ampolloso. Es un tipo de enfermedad ampollosa autoimune. Las erosiones se producen tras la ruptura de las ampollas formadas. La biopsia con inmunofluorescencia directa y la positividad de autoanticuerpos en sangre son claves para su diagnóstico
- Campo de cancerización (múltiples queratosis actínicas +/- carcinoma epidermoide, sobre piel atrófica con daño solar crónico).
¿Cómo se trata?
En el manejo de esta patología destaca el fracaso de las curas con apósitos convencionales, de la compresión, y de los antibióticos locales y sistémicos.
El tratamiento de elección es el uso de un corticoide de potencia alta, cubierto por una interfase y gasas. En la consulta también usamos láminas de alginato o venda de zinc como apósito primario. La frecuencia de aplicación del tratamiento será inicialmente diaria. El tratamiento ha de mantenerse de manera prolongada, una media de 3 meses y la frecuencia de aplicación ha de ir disminuyéndose progresivamente. Al suspender el tratamiento, hasta la mitad de los casos pueden recidivar.2
Una alternativa de tratamiento es el Tacrolimus 0.1%. tópico. La aplicación sería diaria. La resolución puede tardar en alcanzarse 16 semanas. Al contrario que el corticoide tópico, no produce atrofia cutánea. Podría usarse de manera combinada con el corticoide tópico, pautarse tras un ciclo inicial de corticoide tópico o incluso utilizarse de manera profiláctica 2 veces a la semana para evitar la recidiva.4
Referencias:
- Lanigan SW, Cotterill JA. Erosive pustular dermatosis: a common development in atrophic skin. Br J Dermatol 1987; 117: 15.
- Wantz M, Perceau G, Goeldel AL, Grange F, Bernard P. Erosive pustular dermatosis of the legs: retrospective study of 16 cases. Ann Dermatol Venereol. 2011;138(2):93–99.
- Patton D, Lynch PJ, Fung MA, Fazel N. Chronic atrophic erosive dermatosis of the scalp and extremities: a recharacterization of erosive pustular dermatosis. J Am Acad Dermatol. 2007;57(3):421–427
- Dall’Olio E, Rosina P, Girolomoni G. Erosive pustular dermatosis of the leg: long-term control with topical tacrolimus. Australas J Dermatol. 2011;52(1):e15–e17
¿Y si curamos con música?
El dolor en una herida cutánea se dispara durante las curas, que en algunos casos son diarias. Los cambios de apósito pueden llegar a ser un verdadero estresor para nuestros pacientes. No es raro que desarrollen estrategias de afrontamiento maladaptativas, con importante ansiedad anticipatoria asociada. Este miedo a pasar dolor les produce un enorme sufrimiento, altera la relación médico-paciente y, dado que determinará la intensidad del desbridamiento, puede influir en el tiempo de cicatrización.
Dedicaremos otro post a hablar de las diferentes estrategias analgésicas y anestésicas convencionales que podemos usar para mejorar la tolerancia de las curas. Sin embargo, muchas veces no es suficiente el tratamiento farmacológico, se necesita aumento de dosis, con los consiguientes efectos secundarios, posibilidad de habituación y dependencia. Por lo tanto, es necesario un abordaje integral del dolor durante las curas, con especial atención a la gestión de la ansiedad asociada. Hoy vamos a hablar de una técnica menos tradicional: la musicoterapia.
La musicoterapia es la utilización de los efectos de la audición o interpretación de sonidos y melodías con objetivos psicoterapéuticos. Existen diferentes técnicas y tiene aplicabilidad en múltiples campos. Se pueden trabajar habilidades motrices, cognitivas, sensoriales, socio-emocionales.
El dolor es multidimensional, con un componente sensorial, cognitivo y afectivo. Esta dimensión cognitiva-afectiva está muy condicionada por las experiencias dolorosas anteriores, su interpretación y anticipación. El entorno, predominantemente la relación con el personal sanitario, tiene una gran influencia. El objetivo del uso de la música en pacientes que han de pasar por intervenciones dolorosas es lograr una adecuada relajación, disminución del estrés y ansiedad. La música, no su efecto distractor, tiene un potencial efecto analgésico y ansiolítico.
Se han publicado algunos estudios sobre los beneficios que tiene su uso para disminuir el dolor durante las curas, principalmente en unidades de quemados. Los resultados son positivos, con mayor relajación y menor ansiedad.1-3
La mayoría de métodos propuestos son de musicoterapia activa e implican formación del personal de enfermería por un musicoterapeuta. Éste explicaría cómo aplicar y secuenciar los diferentes protocolos musicales, en combinación con el uso de imágenes y técnicas de relajación para optimizar la focalización en la música.
Aunque disponer de la ayuda de un musicoterapeuta sería ideal, la realidad es que en la mayoría de los casos no tenemos esta posibilidad. Sin embargo, la experiencia también es muy buena en unidades de heridas que utilizan música durante las curas sin la intervención de un terapeuta especializado, seleccionada por el paciente (musicoterapia pasiva).4 Si asociamos a la música ambiente técnicas de relajación (respiración) y distracción (hablar con el paciente), potenciaremos el beneficio. Hoy en día disponemos de aplicaciones que permiten seleccionar y escuchar de manera inmediata el tipo de música que queremos escuchar. El paciente se sentirá más autónomo, con más control, en un ambiente seguro y familiar, si puede seleccionar la música que le guste y distraiga. Por otro lado, la música también tiene un efecto positivo en el trabajo del personal sanitario.
Francisca Martín, enfermera de dermatología del Gregorio Marañón y gran amiga, con quién empecé a hacer mis primeras curas de residente, lo tiene muy claro: con música, mucho mejor. Yo también.
Referencias:
La hipergranulación: cuando el lecho de la herida se activa en exceso.
La hipergranulación es un problema con el que nos encontramos frecuentemente en la consulta. Sin embargo, es un tema del que existen pocas publicaciones en la literatura médica. El objetivo de este post es intentar comprender mejor por qué se produce y analizar qué estrategias de tratamiento pueden ser útiles.
¿Qué es la hipergranulación?
Se trata de un exceso de tejido de granulación que se eleva sobre la superficie en el lecho de una herida y, por tanto, dificulta la cicatrización. Se trata de una respuesta aberrante con sobrecrecimiento de fibroblastos y células endoteliales con una estructura similar al tejido de granulación normal. Se presenta con una existencia esponjosa, friable, de color rojo intenso. Es frecuente que se presente en heridas que se dejan cicatrizar por segunda intención.
Los queratinocitos son células que proliferan y migran horizontalmente. El tejido de hipergranulación se comporta como una montaña que obstaculiza su avance en la superficie de la herida para lograr la completa reepitelización.
Si queréis saber más sobre la fisiología del proceso de cicatrización, podéis leer Pinceladas sobre la cicatrización.
¿Por qué se produce?
La hipergranulación en el lecho de la herida puede aparecer por diferentes causas, que comparten un ambiente inflamatorio excesivo. Sin embargo, lo primero que ha de descartarse, sobre todo en heridas de larga evolución o sobre quemaduras previas, es que se trate de tejido tumoral. Tenemos que sospechar que la hipergranulación se está produciendo en el contexto de una transformación maligna cuando su disposición es irregular, dura al tacto, sobrepasa los bordes de la herida, no responde al tratamiento y tiene meses de evolución. Ante la menor duda, ha de realizarse una biopsia.
En la siguiente foto vemos una tumoración con superficie hipergranulada con apariencia de coliflor. Se trata de un carcinoma epidermoide sobre una úlcera de años de evolución sobre quemadura previa.
Una vez descartada la malignidad, entre las condiciones que pueden desencadenar hipergranulación en el lecho de la herida se encuentran:
- Sobreinfección: se suele asociar a exudado elevado, maceración de bordes y sangrado.
- Dermatitis irritativa, dermatitis alérgica de contacto: secundaria a las fibras y otros componentes de los apósitos y productos tópicos utilizados.
- Oclusión: se ha asociado la hipergranulación con el uso de apósitos oclusivos, tipo hidrocoloide. Este efecto se ha asociado con varios factores, como la estimulación de la acción de los factores de crecimiento, aumento del edema por el lecho por exudado excesivo y producción de nuevos vasos para compensar el ambiente de hipoxia local.
- Fricción: en zonas de roce con dispositivos externos como tubos de gastrostomía y catéteres.
¿Cómo se debe tratar la hipergranulación?
Dada la escasez de estudios realizados, no existe un manejo estandarizado de la hipergranulación en las úlceras cutáneas crónicas. Se han propuesto diferentes tratamientos basados en pequeñas series de casos, pero se necesitan ensayos clínicos sólidos para poder determinar y comparar su utilidad.
Vamos a resumir las alternativas disponibles en función del problema desencadenante que se sospeche:
- Si existen signos de sobreinfección: se recomienda la utilización de productos con propiedades antibacterianas y, en caso de sospecha, descartar mediante pruebas complementarias la presencia de un absceso subyacente.
- Apósitos que disminuyan la humedad y ejerzan presión sobre la herida para disminuir el edema: cambio de un apósito oclusivo a uno no oclusivo. En caso de úlceras en pierna es fundamental optimizar la compresión terapéutica.
- Barras de nitrato de plata: algunos autores lo señalan como uno de los tratamientos más efectivos. Sin embargo, dado que disminuye la proliferación de fibroblastos, ha de evitarse un uso prolongado y limitarlo sólo a las zonas más resistentes. Se debe proteger la piel perilesional para evitar una quemadura química.
- Curetaje o escisión quirúrgica: no es muy recomendable dado que puede dañar tejido sano, producir sangrado y promover la infección.
- Corticoide tópico: por su efecto antiinflamatorio, la respuesta suele ser buena aplicado durante una semana. Yo es lo que más utilizo.
- Otros tratamientos menos utilizados: láser, crioterapia, imiquimod (Lain,2015).
¿Cuál es vuestra experiencia? ¿Cómo manejáis la hipergranulación?
Referencias:
- Chaverri Fierro D. Hipergranulación en heridas crónicas: un problema ocasional pero no infrecuente. Gerokomos. 2007;18(3): 48-52.
- Hampton S. Understanding overgranulation in tissue viability practice. Br J Community Nurs. 2007 Sep;12(9):S24-30.
- Lain EL, Carrington PR. Imiquimod treatment of exuberant granulation tissue in a non-healing diabetic ulcer. Arch Dermatol 2005; 141: 1368-70.
¿Por qué se producen calcificaciones en las úlceras cutáneas crónicas?
Este fin de semana ha tenido lugar en Valencia el 23 Congreso Nacional del Capítulo Español de Flebología y Linfología y el I Encuentro Multidisciplinar de Flebedema y Linfedema. Me han parecido unas reuniones interesantísimas que han reflejado claramente la necesidad del trabajo coordinado entre diferentes especialistas, como cirujanos vasculares, médicos de familia, internistas, enfermeros, médicos rehabilitadores, fisioterapeutas.
¿Y los dermatólogos? ¿Cuántos pacientes vemos en nuestra práctica clínica diaria con motivos de consulta relacionados con insuficiencia venosa crónica o patología linfática? ¿Qué porcentaje de nuestro programa formativo durante la residencia está dedicado a la flebología y la linfología? Ahí queda una reflexión.
Durante el congreso, he tenido el placer de conocer a Carmen Alba Moratilla, Responsable de la Unidad Funcional de Heridas en el Hospital Clínico de Valencia, una gran experta en úlceras cutáneas. En uno de los talleres prácticos que impartió durante el congreso, un paciente presentaba calcificaciones distróficas en el contexto de una úlcera venosa crónica. En la radiografía se observaba una imagen típica, con múltiples focos radiopacos subyacentes a la herida.
Dado que no es un hallazgo inusual, pero existe poca literatura científica al respecto, el post de hoy lo dedicaré a las calcificaciones distróficas en las úlceras venosas crónicas.
Cuando hablamos de calcificaciones nos referimos a depósitos anormales de sales insolubles de calcio. Cuando se disponen de manera organizada formando hueso, se denominan osificaciones.
Calcinosis cutis es el término utilizado cuando esta calcificación ocurre en el tejido cutáneo y se puede clasificar de la siguiente manera (Urbina, 2001):
- Calcificación distrófica, por daño tisular secundario a traumatismos, quemaduras, procesos inflamatorios, degenerativos, neoplásicos,…
- Calcificación metastásica, asociada a diversos trastornos que cursan con elevación de los niveles plasmáticos de calcio y/o fósforo.
- Calcificación idiopática, que no se relaciona con daño tisular ni trastornos metabólicos.
El grupo más frecuente es el de calcificaciones distróficas. Dentro de las causas inflamatorias, se encuentra la insuficiencia venosa crónica, con o sin presencia de úlcera cutánea. El metabolismo calcio-fósforo y sus niveles séricos son normales. Se han propuesto diferentes hipótesis para explicar el desarrollo de estas calcificaciones ectópicas. La anoxia e inflamación que se produce en las piernas con hipertensión venosa implica la necrosis celular y la liberación de células y mediadores inflamatorios, con la producción de radicales libres y el daño del tejido conectivo (colágeno, elastina) o la grasa subcutánea. En este tejido dañado, por un lado pueden aumentar los niveles de calcio intracelular, con la consiguiente formación y precipitado de cristales. Por otro lado, las proteínas desnaturalizadas se unen al fosfato y permiten su unión al calcio, con la consiguiente precipitación de fosfato cálcico.
El diagnóstico de puede realizar mediante la palpación y visualización en radiografía o ecografía (Piry, 1992).
Cuando el paciente presenta una úlcera cutánea, esta calcificación puede hacerse visible, como un material duro de consistencia ósea y coloración marrón oscura. Normalmente se encuentran fuertemente adheridos al lecho de la herida, con importante dolor al intentar traccionar. Estos depósitos actúan como un cuerpo extraño, que promueve la respuesta inflamatoria en la herida y, por tanto, frena la cicatrización. Un estudio restrospectivo con 212 pacientes con úlceras crónicas de piernas (sin respuesta a tratamiento convencional al menos durante 3 meses), halló calcificaciones en el 18% y osificaciones en el 7% de los pacientes. La presencia de estos depósitos anómalos se asoció con mayor dolor y peor respuesta al tratamiento compresivo (Wollina, 2009).
El principal diagnóstico diferencial radiológico ha de realizarse con los flebolitos, que se corresponden con calcificaciones parietales venosas tras episodios de trombosis venosa profunda.
Existen diferentes opciones en el tratamiento de estas osificaciones en las úlceras cutáneas, pero todas implican su retirada del lecho de la herida (Chaverri,2011; Enoch, 2005):
- Lograr un desprendimiento de la calcificación al aportar humedad a la herida con apósitos tipo hidrogel
- Retirada mecánica con pinza y bisturí. Dado que es doloroso, se recomienda anestesiar previamente la zona
- Exéresis quirúrgica bajo anestesia
- El desbridamiento radical de la úlcera, con o sin cobertura posterior con injerto cutáneo.
Referencias:
- Chaverri Fierro D, Portas Freixes J, Bosch Cuenca M, Sáez Horts M, Montoya Hellín I, González Sierra M et al. Calcificación distrófica en úlceras de la extremidad inferior. Gerokomos 2011; 22 (3): 126-130.
- Enoch S. Kupitz S, Miller DR and Harding KG. Dystrophic calcification as a cause for non healing leg ulcers. Int Wound J 2005; 2:142-147.
- Piry A, Vin F, Allaert FA. Inflammation and subcutaneous calcification of venous origins. Fhlebologie 1992; 45 (1): 41-7.
- Urbina F, Pérez L, Sudy E, Misad C. Calcificación y osificación cutánea. Actas Dermosifiliogr. 2001;92:255-69.
- Wollina U, Hassenöhrl K, Köstler E, Schönlebe J, Heinig B, Haroske G, Kittner T, Dystrophic calcification in chronic leg ulcers – a clinocopathologic study. Dermatol Surg 2009; 35(3): 457-61.
Las metaloproteinasas en las heridas crónicas: el problema de una actividad destructiva descontrolada

Como comentamos en el post de Pinceladas sobre la cicatrización, independientemente de su causa, todas las úlceras crónicas comparten una misma característica: una fase inflamatoria anormalmente prolongada. En este microambiente proinflamatorio destaca la presencia de una mayor actividad de unas enzimas que destruyen la matriz extracelular e impiden la acción de los factores de crecimiento. Estas proteínas se denominan metaloproteinasas, y se han convertido en una diana prometedora en el desarrollo de nuevos apósitos bioactivos.
¿Por qué hay tanto interés en el uso de apósitos moduladores de las metaloproteinasas? Los siguientes puntos te ayudarán a comprenderlo.
¿Qué son las metaloproteinasas de la matriz (MMPs)?
Son una familia de enzimas con una misma función: la destrucción de proteínas de la matriz extracelular, como colágeno o proteoglicanos.
Se han descrito 23 tipos. De ellas, las más identificadas y estudiadas en heridas son MMP-1, MMP-2, MMP-8 y MMP-9.
Las MMPs intervienen en todas las fases del proceso de cicatrización normal y son producidas por:
- Células inflamatorias (neutrófilos y macrófagos)
- Células del tejido de la herida (células epiteliales, fibroblastos y células endoteliales)
| Fases de la cicatrización | Acción de las MMPs |
| Inflamación |
|
| Proliferación |
|
| Remodelación |
|
Se excretan inactivas (en forma de pro-MMP). Para ejercer su acción proteolítica han ser activadas por otras proteasas. Su inactivación depende de enzimas tisulares denominadas TIMPs (Inhibidores Tisulares Mayores de las Metaloproteinasas). Lo importante es la relación MMPs/ TIMPs.
¿Por qué tienen tan mala fama las MMPs en las úlceras cutáneas crónicas?
Al contrario de las heridas agudas, que cicatrizan adecuadamente, en las úlceras crónicas las MMPs se mantienen a niveles elevados durante largo tiempo, destruyendo proteínas esenciales para la cicatrización (factores de crecimiento, colágeno, fibronectina). En estas heridas recalcitrantes también disminuyen los TIMPs, por lo que la ecuación MMPs/TIMPs aumenta, con un peligroso balance proteolítico positivo. Las concentraciones elevadas de MMPs se correlacionan con tasas bajas de cierre de las heridas.
Los biofilms que se generan colaboran en esta actividad proteolítica. Por un lado, las bacterias se organizan formando matrices adherentes en las que segregan moléculas citotóxicas y proteasas bacterianas. Por otro, dado que este tipo de organización las hace más resistentes, aumenta el número de células inflamatorias en la herida, que liberan más citoquinas, radicales libres y, por tanto, se estimula la producción de proteasas. Esta respuesta, que no es efectiva y produce un círculo vicioso, impide la regeneración de una adecuada matriz extracelular.
¿Cómo evitar su acción?
La actividad de las metaloproteinasas se puede reducir mediante diferentes mecanismos:
- Retirada de las proteasas del lecho de la herida, mediante apósitos absorbentes (el exudado es un líquido rico en proteasas), desbridamiento cortante o mediante terapia de presión negativa.
- Disminución de la actividad proteasa, por unión a las MMP y consiguiente inactivación. Con esta función se han comercializado apósitos de colágeno y celulosa regenerada oxigenada, y malla microadherente con Factor Nano-OligoSacárido.
- Inhibición de la síntesis de MMP, mediante apósitos impregnados en ionógenos polihidratados.
- Los productos antimicrobianos, al reducir la carga bacteriana, ayudarían a reducir la actividad proteolítica en las heridas
Mi experiencia con este tipo de apósitos es muy buena. Sin embargo, la carga o la actividad de las MMPS no es un parámetro que podamos medir en la práctica clínica diaria. Ya que estos apósitos, además de poder tener otras propiedades beneficiosas en la cicatrización (como el aporte de proteínas de matriz, mantenimiento de la cura húmeda o la combinación con antimicrobianos), se usan en combinación con otros tratamientos (como el desbridamiento y la terapia compresiva en úlceras venosas), es difícil determinar el impacto clínico su acción específica sobre las metaloproteinasas.
Os recomiendo la siguiente revisión: MMPs Made Easy
¿Por qué le damos más importancia a elegir el mejor apósito que a realizar la mejor compresión?
Hay tres razones que podrían explicarlo:
- Desconocimiento de la fisiopatología de la úlcera venosa.
- Ausencia de formación en la técnica de la compresión.
- Dificultad para llevar a la práctica los conocimientos teóricos.
En el manejo de una úlcera venosa, centrarse exclusivamente en el tratamiento local de la herida es un error de concepto. Sin duda, es esencial el correcto cuidado de la herida y de la piel perilesional, pero el abordaje ha de ser etiológico, con una adecuada exploración vascular y una compresión eficaz.
La compresión es un pilar esencial en el tratamiento de las úlceras venosas, ya que disminuye la hipertensión venosa que, como vemos en el esquema, es el principal desencadenante de estas lesiones.
Una vez que entendemos porqué es importante la compresión, toca formarse para su aplicación. Es importante conocer los tipos de dispositivos de compresión existentes (vendas elásticas o inelásticas, medias), las clases de vendajes que se pueden realizar (en función del número y tipo de vendas y su superposición) y sus propiedades in vitro (elasticidad, estiramiento, histéresis) e in vivo (rigidez, presión en reposo y durante contracción muscular).
Hasta aquí, la teoría. Pero el verdadero problema se presenta cuando queremos aplicar todos estos conocimientos a la compresión en nuestro paciente, que es mayor, no tiene movilidad, es diabético o presenta arteriopatía periférica.
Para hacernos una idea de esta dificultad, basta con echar una ojeada a los títulos de las diferentes ponencias que se han presentado en la sesión sobre compresión en el 49 congreso del Collège Français de Pathologie Vasculaire, que acaba de tener lugar en París:
- Compresión y arterias: ¡qué dilema!
- Venas y compresión: ¡qué desgracia!
- Compresión y alteraciones tróficas: ¿elasticidad alta, baja?
El planteamiento de las charlas me pareció muy interesante, ya que se centraron en los problemas que nos encontramos en la práctica clínica. Aquí expongo algunos:
Compresión sí, ¿pero cuál es la más adecuada para mi paciente?
Varios estudios analizan el beneficio de la compresión en la cicatrización de las úlceras venosas y comparan los diferentes tipos de compresión existentes (O’Meara. Cochrane Database Syst Rev, 2012). Las principales conclusiones de estos ensayos clínicos son las siguientes:
- La compresión con vendas múltiples de diferente componente es superior a la obtenida con vendaje monocomponente.
- La compresión con vendaje multicomponente con 3 vendas tiene una eficacia superior si una de ellas es elástica.
- La compresión con vendaje multicomponente con 4 vendas es superior a las vendas inelásticas.
- La superposición de 2 medias de compresión tiene la misma eficacia que el vendaje multiicomponente con 4 vendas (con una presión en el tobillo superior a 35 mmHg en ambos grupos).
En la práctica, la conclusión sería que, en casos de úlceras venosas sin arteriopatía o neuropatía asociada, lo ideal es el uso de un vendaje multicomponente, con una de las vendas de material elástico. En los casos en los que sea posible, porque la úlcera es pequeña, poco exudativa y el apósito no se desliza, es útil la utilización de una media de compresión fuerte (>30 mmHg), o dos medias superpuestas (de compresión ligera y moderada, respectivamente).
¿Qué presión se ejerce realmente?
La verdad es que la desconocemos.
Para la promoción de la cicatrización de las úlceras venosas, la recomendación es realizar compresión fuerte (>30-40 mm Hg) y, en caso de arteriopatía o neuropatía, no superar los 30 mmHg. Esta medida se toma con un dispositivo que se coloca en el tobillo e indica la presión ejercida en ese punto. Sin embargo, la presión ejercida es diferente en cada punto de la pierna (Ley de Laplace) y la morfología de las piernas de nuestros pacientes suele ser muy irregular.
En la práctica diaria no usamos este dispositivo. Para tener una referencia de la presión que estamos ejerciendo, algunas vendas tienen dibujos que varían de forma en función del estiramiento que sufren. Con una venda de alta elasticidad podemos conseguir un vendaje rígido si no la estiramos y hacemos las vueltas en espiga. También sabemos que cuantas más capas aplicadas y mayor superposicón del vendaje, mayor presión. Si utilizamos medias, que están diseñadas para ejercer una presión determinada a nivel del tobillo, podremos tener una idea del rango aproximado en el que nos movemos.
También tenemos que tener en cuenta la movilidad del paciente. El vendaje rígido no ejerce prácticamente presión en reposo, pero sí con la contracción muscular, por lo que es beneficioso en caso de existir riesgo arterial. La presión de un vendaje poco rígido es elevada tanto en el reposo como durante el ejercicio, por lo que es el más interesante en pacientes con movilidad reducida.
En conclusión, hay que intentar que la pierna del paciente se aproxime a un cilindro uniforme (con capas de venda) y proteger las prominencias óseas para evitar daño por exceso de presión. Con una venda de material elástico podemos conseguir un vendaje rígido, con poco estiramiento y capas solapadas en espiga. En pacientes con arteriopatía o neuropatía debe utilizarse vendaje rígido y realizarse un seguimiento estrecho. En caso de dolor, ha de reevaluarse el tipo de compresión que se está aplicando.
¿El índice tobillo-brazo (ITB) es la medida más apropiada para determinar la indicación de compresión en caso de arteriopatía?
Estamos acostumbrados a establecer la idoneidad de la compresión en función del ITB. En caso de que este se encuentre entre 0.8 y 0.5, la compresión se recomienda que sea inelástica y no supere los 30 mmHg (La compresión que no supera este valor ha mostrado un papel beneficioso en la microcirculación). Si el ITB es inferior a 0.5, la compresión estaría contraindicada.
Sin embargo, el ITB es un indicador de arteriopatía, no de isquemia (contraindicación verdadera para la compresión). Además, este índice puede estar falsamente elevado por la calcificación de la media arterial.
Por lo tanto, en casos de duda (calcificación arterial, paciente diabético), el riesgo arterial debe ser definido mediante la combinación del examen clínico (características del dolor y alteraciones tróficas) y medidas absolutas de isquemia crónica (presión sistólica en el primer dedo del pie y en el tobillo).
En fin, aquí os dejo el link de un documento de consenso sobre la compresión en la práctica clínica: Compresión en las úlceras venosas de las extremidades inferiores. Documento de consenso. Viene muy bien para aclarar conceptos en este mar de dudas…
Claves para entender la úlcera de Martorell
Luisa (nombre ficticio) acude a nuestra consulta con una úlcera muy dolorosa, de 6 meses de evolución, que le han estado curando con diferentes apósitos sin mejoría.
Es una paciente hipertensa en tratamiento desde hace años, pero mal controlada, y diabética tipo II.
Cuenta que, tras un traumatismo, apareció una lesión violácea que progresó rápidamente hacia una úlcera profunda. El dolor no aumenta con el ejercicio o la elevación de la pierna.
A la exploración física, llama la atención la localización de la lesión en la cara interna del tercio distal de la pierna, con bordes purpúricos socavados, bien definidos, y fondo de aspecto necrótico. Los pulsos distales están preservados.
En la analítica de sangre no encontramos ninguna alteración de interés. La función renal era estrictamente normal.
Realizamos una biopsia incisional profunda del borde de la úlcera. Los hallazgos histológicos corresponden a una arterioloesclerosis subcutánea isquémica.
Ante esta clínica e histología compatibles, establecimos el diagnóstico de úlcera de Martorell.
Se modificó el tratamiento antihipertensivo, con lo que se obtuvo un adecuado control.
Realizamos curas cada 72 horas: limpiamos con solución de polihexanida, colocamos una matriz de colágeno y celulosa moduladora de proteasas y cubrimos con lámina de silicona y gasa. Se aplicó vendaje compresivo bicomponente para alcanzar una compresión terapéutica (si no hay contraindicación, toda úlcera en pierna se beneficia de la terapia compresiva, ya que ayuda a disminuir la inflamación local).
A las 8 semanas, conseguimos la reepitelización completa de la lesión.
Otra opción de tratamiento habría sido aplicar corticoide tópico y realizar una cobertura precoz con injertos en sello (Ver post: «El interés del corticoide tópico en la úlcera de Martorell» e » Interés de la precocidad de los injertos en sello en la úlcera de Martorell»
Aprovechando este caso, vamos a intentar dar respuesta a algunas preguntas que muchos nos habremos planteado en alguna ocasión:
¿Por qué se llama úlcera de Martorell?
Recibe este nombre porque fue el cirujano cardiovascular español Fernando Martorell, primer presidente de la Sociedad Española de Angiología (y hermano del también angiólogo Alberto Martorell, portero mítico del Espanyol) el que describió los primeros casos en 1945. Destacó que se trataba de pacientes con antecedente de hipertensión arterial y las úlceras no se asociaban a insuficiencia venosa crónica o enfermedad arterial periférica. Un año más tarde, Hines y Farber, de la Clínica Mayo, asociaron la existencia de estas úlceras con la presencia de arteriolas subcutáneas hipertróficas y estenóticas, y acuñaron el término de úlcera hipertensiva-isquémica. En la literatura anglosajona se emplea la denominación de úlcera isquémica hipertensiva de Martorell, que es más descriptiva que el epónimo aislado.
¿Por qué, si la hipertensión arterial es tan frecuente, estas úlceras no son tan prevalentes?
Hay diferentes teorías para explicar la aparición de estas lesiones. Lo que está claro es que la hipertensión arterial no es condición suficiente, por lo que debe asociarse a otras alteraciones.
Un elevado porcentaje de pacientes también presenta diabetes mellitus.
En estos pacientes se ha encontrado una alta resistencia vascular, que evitaría la relajación compensatoria distal que se produce normalmente en casos de obstrucción vascular, con la consiguiente disminución de la perfusión distal y la aparición de las heridas. También se ha propuesto una alteración de la inervación simpática.
Por otro lado, no es infrecuente que la úlcera de Martorell se desencadene tras un traumatismo.
¿A qué se debe el aumento de su incidencia?
Por un lado, se debe a un mayor reconocimiento de esta entidad y, por otro, al aumento de la esperanza de vida de los pacientes hipertensos en tratamiento. Los eventos cardiovasculares mayores disminuyen, pero la presencia de hipertensión arterial, aunque esté controlada, representa una complicación menor en estos pacientes.
¿Por qué aparece característicamente en la cara ántero-externa de la pierna?
Lo más frecuente es que aparezca en la cara ántero-lateral de la pierna, pero también suelen presentarse a nivel del tendón de Aquiles y en otras zonas del tercio medial y distal de pierna. Hasta en un 50% de los casos son bilaterales y simétricas.
Se ha sugerido que esto es debido a las características anatómicas de las arterias y a la distribución de las arteriolas subcutáneas de esa zona de la pierna. Sin embargo, se precisan estudios para definir la implicación real de estos factores.
¿Por qué es necesario realizar una biopsia?
La clínica compatible y la historia de hipertensión arterial de larga evolución nos hacen sospechar una úlcera de Martorell.
Sin embargo, hay otras patologías que también pueden presentarse con úlceras en piernas dolorosas de aspecto necrótico y bordes eritemato-violáceos bien definidos y crecimiento rápido. Este es el caso de otras vasculopatías oclusivas, calcifilaxis, vasculitis o pioderma gangrenoso.
Algunas de estas patologías se presentan característicamente con otras alteraciones asociadas, como el fallo renal en la calcifilaxis o la presencia de auto-anticuerpos en algunas vasculopatías. Sin embargo, el diagnóstico diferencial no es tan sencillo en el caso del pioderma gangrenoso, ya que no presenta datos patognomónicos y se trata en muchas ocasiones de un diagnóstico de exclusión.
Los hallazgos histológicos ayudan a establecer el diagnóstico. La úlcera de Martorell se caracteriza por una arterioloesclerosis subcutánea oclusiva, con engrosamiento de la pared y disminución del calibre, en ausencia de signos de vasculitis. Si la biopsia no es suficientemente profunda y extensa, puede observarse únicamente necrosis cutánea y un infiltrado inflamatorio, y confundirse con pioderma gangrenoso. Dado que el tratamiento del pioderma gangrenoso es completamente distinto al de la úlcera de Martorell (mejora con tratamiento inmunosupresor y empeora con desbridamiento cortante), es esencial diferenciarlos.

¿Cómo hay que tratar estas úlceras? ¿Es suficiente con conseguir un adecuado control tensional?
Es esencial el control de la tensión arterial y la diabetes, en caso de que se presente. Hay que señalar que estas lesiones aparecen en pacientes con hipertensión arterial bien y mal controlada. Hay casos en los que el adecuado tratamiento mejora la cicatrización de la úlcera, pero hay otros en los que, a pesar de presentar un buen control, no se consigue una buena evolución clínica.
Como se trata de úlceras muy dolorosas, el tratamiento analgésico es un pilar esencial.
En las curas, ha de realizarse una buena limpieza, con desbridamiento cortante para eliminar el tejido necrótico y evitar el riesgo de infección.
Dado que en muchas ocasiones se trata de úlceras resistentes a tratamiento convencional, la aplicación de terapia de presión negativa o el uso de injertos cutáneos pueden ser necesarios para conseguir su cicatrización.
Si no existe contraindicación, como en toda herida de pierna, el vendaje compresivo (adaptado a la tolerancia del paciente) disminuye la inflamación y facilita la cicatrización de las lesiones.
Referencias
- Alavi A, Mayer D, Hafner J, Sibbald RG. Martorell hypertensive ischemic leg ulcer: an underdiagnosed Entity©. Adv Skin Wound Care. 2012;25(12):563-72.
- Hafner J, Nobbe S, Partsch H, Läuchli S, Mayer D, Amann-Vesti B, Speich R, Schmid C, Burg G, French LE. Martorell hypertensive ischemic leg ulcer: a model of ischemic subcutaneous arteriolosclerosis. Arch Dermatol. 2010;146(9):961-8.
- Vuerstaek JD, Reeder SW, Henquet CJ, Neumann HA. Arteriolosclerotic ulcer of Martorell. J Eur Acad Dermatol Venereol. 2010;24(8):867-74.