Acaba de tener lugar la X Reunión del Grupo Español de Dermatología Psiquiátrica de la Academia Española de Dermatología y Venereología. La mente y la piel surgen de la misma capa embrionaria, el ectodermo. Este origen común ayuda a entender muchas patologías cutáneas con componente psicológico asociado, que se pueden clasificar en 3 subgrupos:
- Trastornos psicofisiológicos: patología cutánea exacerbada por factores psicológicos
- Psoriasis, dermatitis atópica, acné, urticaria, prurito, alopecia
- Trastornos psiquiátricos primarios: síndromes psiquiátricos con expresión dermatológica
- TOC, Tricotilomanía, dermatosis facticias, dismorfismo corporal, delirium parasitorum, glosodinia, vulvodinia
- Trastornos psiquiátricos secundarios: Impacto psicosocial de la patología cutánea
En el campo de las heridas cutáneas, la psicodermatología tiene un papel esencial.
Por un lado, el impacto psicosocial de las heridas cutáneas crónicas limita en gran medida la calidad de nuestros pacientes. Hay un especial interés en la validación de escalas de calidad de vida para cuantificar este impacto, con los costes socio-económicos que conlleva.
Por otro lado, y es el tema en el que nos vamos a centrar hoy, están las lesiones facticias o artefactas, que representan un reto diagnóstico y terapéutico, con un consumo elevado de tiempo y recursos.
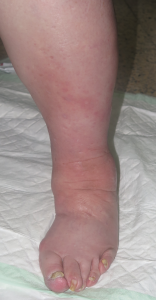
La dermatosis artefacta incluye un espectro amplio de lesiones cutáneas auto-provocadas por el paciente, que niega su responsabilidad en la aparición de las mismas. La motivación para la producción de estas heridas es la satisfacción de una necesidad psicológica inconsciente, normalmente el deseo de recibir cuidado médico. Por tanto, muchas veces se puede encuadrar en un síndrome de Munchausen, en el que el paciente, de manera repetida, se provoca lesiones en diferentes órganos y busca ser estudiado y tratado en diferentes hospitales. Es frecuente que se trate de pacientes con antecedentes de maltrato infantil, abuso sexual, trastorno de la personalidad, depresión, ansiedad, trastorno de control de impulsos.
Ha de diferenciarse de las lesiones producidas por simuladores, que también niegan su autoría, pero lo realizan de manera consciente por conseguir una ganancia, normalmente económica o judicial. En los trastornos facticios, la motivación es inconsciente.
Existen pocas series en la literatura sobre dermatosis facticias, ya que no es un diagnóstico fácil de establecer. Los datos disponibles apuntan que es más frecuente en mujeres de edad media y que predomina en personas con escaso nivel sociocultural. La clínica con la que se pueden manifestar estos trastornos varía en función de la manera en que se produzcan las lesiones: excoriaciones (uñas, objetos cortantes), ampollas, costras, paniculitis (inyección de sustancias), eccema (irritantes), hematomas, úlceras (objetos punzantes, cáusticos). La actitud de los pacientes puede dar pistas sobre la auto-provocación de las lesiones, desde una tranquilidad y complacencia llamativas (belle indifference), hasta una excesiva preocupación con muestras de enfado por la presencia de las lesiones.
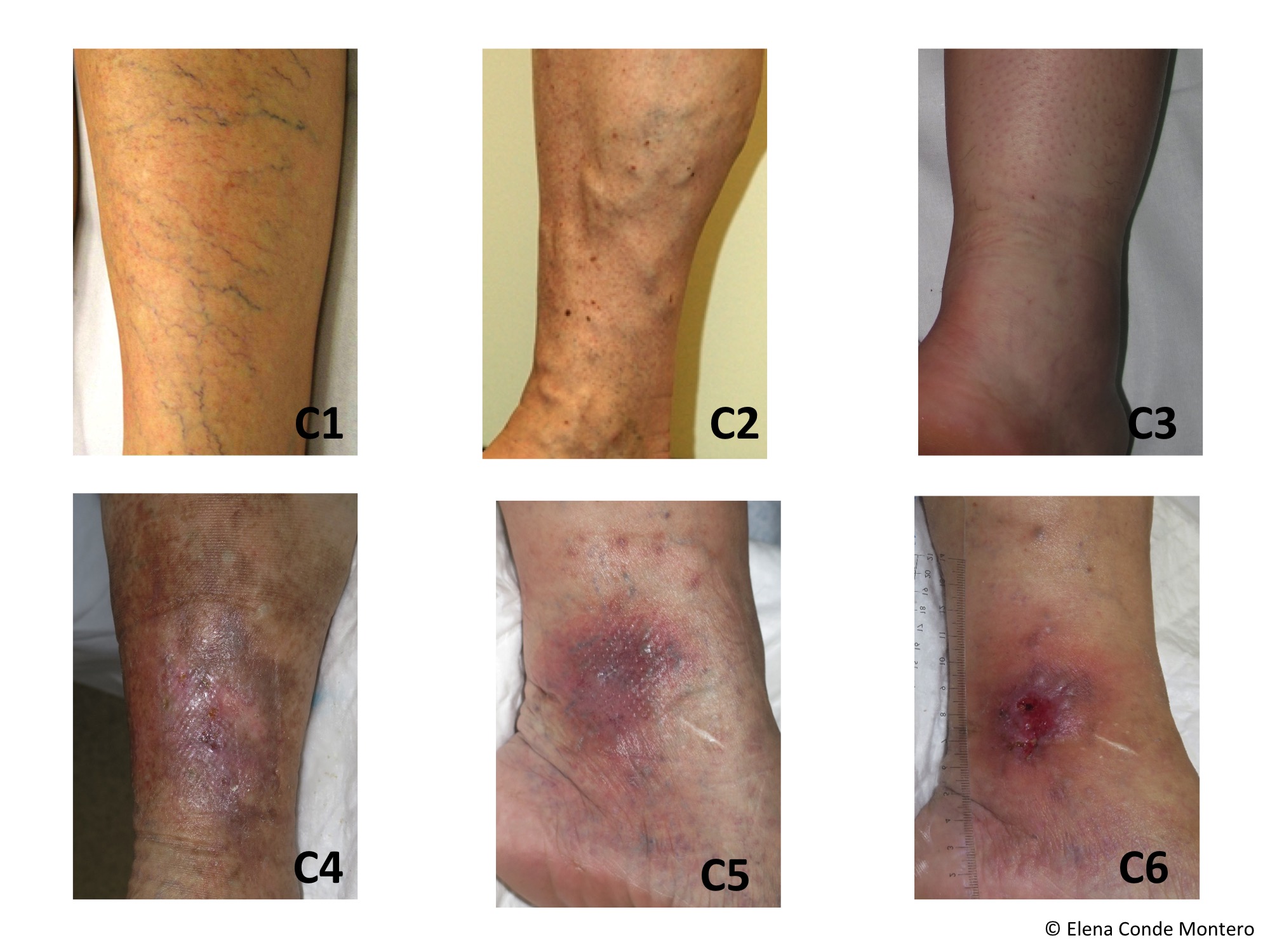
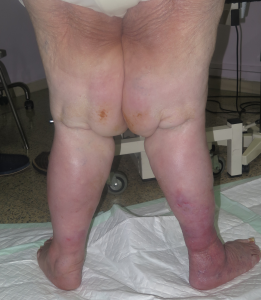
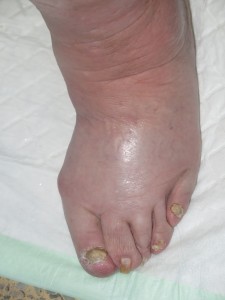
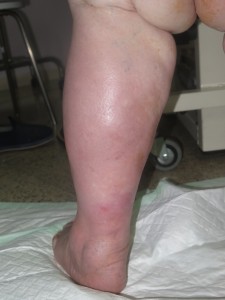
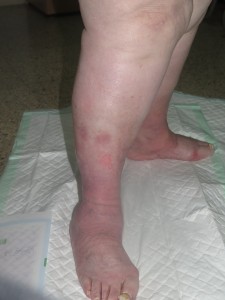
Hasta un 30% de las dermatosis facticias se presentan como úlceras cutáneas. Se trata de lesiones “que no curan” a pesar de un tratamiento adecuado. La morfología de estas úlceras es peculiar, con bordes geométricos en ocasiones, y su evolución es inexplicable, con empeoramiento asociado a momentos estresantes. A veces se asocian lesiones en la periferia o en otras localizaciones, más agudas o crónicas, que nos pueden dar una idea del tipo de mecanismo utilizado para su producción (por ejemplo, quemadura con un cáustico).
Sin embargo, dado que se trata de un diagnóstico de exclusión, a pesar de una sospecha fuerte, ha de realizarse una historia clínica completa y batería de pruebas complementarias para descartar otras patologías que pueden cursar con úlceras de aspecto similar.
Diagnóstico diferencial:
- Etiología venosa
- Vasculopatía oclusiva
- Vasculitis
- Etiología tumoral
- Proceso infeccioso
- Causa farmacológica
- Pioderma gangrenoso
Pruebas complementarias:
- Biopsia incisional profunda:
- Borde inflamado : H-E, Gram, tinciones especiales
- Borde de úlcera: cultivo (incluido micobacterias atípicas)
- Analítica de sangre completa:
- Hemograma, bioquímica, proteinograma, autoinmunidad
- Pruebas de imagen
En muchos casos, el diagnóstico es complicado y nunca se llega a descubrir cómo se produce las lesiones el paciente. De hecho, no es infrecuente el diagnóstico de una úlcera artefacta tras haber sido tratada como una lesión de otra etiología, frecuentemente pioderma gangrenoso (que es otro diagnóstico de exclusión). Una clave diagnóstica es la mejoría con tratamiento exclusivo con cura oclusiva, sin posibilidad de manipulación. Para esta supervisión estrecha, en ocasiones se precisa el ingreso del paciente.
Esta patología precisa un abordaje multidisciplinar, con comunicación fluida y acuerdo en el manejo entre los diferentes profesionales. El diagnóstico, seguimiento y tratamiento ha de realizarse de manera conjunta entre dermatología y psiquiatría.
Se recomienda evitar la confrontación directa, establecer una relación de confianza médico-paciente, y explorar la dimensión psicológica mediante diálogo socrático, con preguntas abiertas. No hay que olvidar que el paciente consulta por un problema en la piel, no mental, y muchas veces puede rechazar la ayuda psiquiátrica.
El tratamiento de las dermatosis artefactas puede llegar a ser frustrante para el dermatólogo. Dado que la ganancia inconsciente de muchos pacientes es la recepción de cuidados médicos, su objetivo no es curarse. Es frecuente la aparición de nuevas lesiones o empeoramiento de las previas cuando se acerca el momento del alta. Ha de planificarse un seguimiento continuado para evitar estos rebrotes.
El pronóstico de estos pacientes es malo, con un porcentaje elevado de recidivas y posibilidad de intentos autolíticos. No podemos olvidar el riesgo de complicaciones infecciosas de estas lesiones y la potencial iatrogenia al sospechar otras patologías que precisan tratamientos agresivos, como inmunosupresión en el caso del pioderma gangrenoso.
Ante una úlcera artefacta, siempre tenemos más preguntas que respuestas.
Si queréis profundizar más en el tema de la dermatitis artefacta, os recomiendo que leais esta interesante revisión, con una excelente iconografía: Dermatitis artefacta: revisión