En los últimos años se ha despertado un gran interés por el estudio de las interacciones entre distintas especies microbianas en una herida y entre las especies microbianas y el sistema inmunitario de esa persona.
El microbioma de la piel, debido a su naturaleza dinámica, tiene un papel variable en el microambiente de las heridas. De hecho, su acción es dual, ya que puede tener un efecto perjudicial en la cicatrización de la herida pero, por el contrario, también lo puede favorecer.(1,2,3) Parece que la influencia positiva o negativa del microbioma dependería de la abundancia relativa de algunas especies, y que el papel de los comensales que habitan en la piel depende del contexto. Las alteraciones en el sistema de defensa del huésped y los factores de riesgo predisponentes (por ejemplo, carga bacteriana, edad, respuesta inmunitaria, estado nutricional, enfermedades coexistentes, medicación concomitante) pueden contribuir a la patogenicidad de algunos comensales. Además, variables como la etiología de la herida, su localización y la situación basal de la persona influyen en la constitución dinámica de los comensales cutáneos.(4)
Sabemos que la sobrecarga bacteriana puede estancar el proceso de cicatrización debido a la mayor abundancia de proteasas, especies reactivas de oxígeno y citoquinas proinflamatorias, especialmente si están presentes ciertas especies bacterianas.(5)

Por ejemplo, aunque el S. aureus es una bacteria poco frecuente en la flora cutánea humana, su exceso se asocia con tasas elevadas de infección cutánea y su prevalencia en el lugar de la herida tiene más probabilidades de provocar la cronicidad de la misma. S. aureus secreta varias toxinas que inducen una respuesta proinflamatoria y favorecen la propagación bacteriana al dañar el tejido y aumentar la permeabilidad vascular. Además, esta bacteria puede formar biopelículas (matrices poliméricas) con actividades antifagocíticas, que reducen la difusión de fármacos y anticuerpos, así como la penetración de células inmunitarias. (6)
Se ha demostrado que comensales como S. epidermidis limitan la formación de biopelículas de S. aureus, lo que pone de relieve el papel dinámico del microbioma cutáneo. Además, algunas cepas de S. aureus se asocian a malos resultados de cicatrización e infección, mientras otras refuerzan la respuesta del huésped y la regeneración cutánea.(7) Por otro lado, teniendo en cuenta que las heridas crónicas son más prevalentes en la población mayor, hay que tener en cuenta que la abundancia global de bacterias aumenta con la edad, pero esto no es directamente proporcional, ya que ciertas bacterias se vuelven más dominantes (por ejemplo, Corynebacterium) mientras que otras disminuyen en número (por ejemplo, Cutibacterium y Lactobacillus),lo que también podría tener un impacto en la cicatrización. (7)
Ahora vamos a centrarnos en el efecto “pro-cicatrización” de la microbiota;)
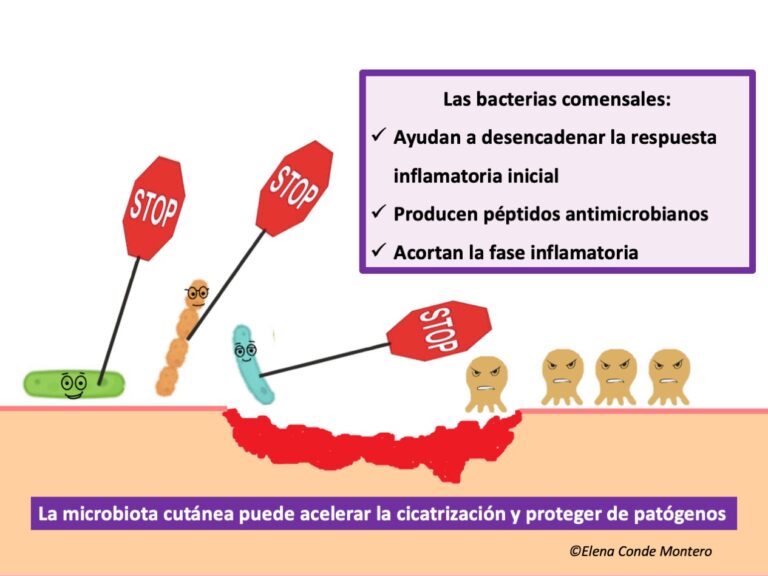
La presencia de bacterias comensales puede modificar el microambiente de la herida para prevenir o resolver la infección bacteriana de la herida y acelerar su cierre. De hecho, cuando se produce una lesión cutánea, las señales procedentes de las bacterias comensales son esenciales para provocar respuestas inmunitarias. La microbiota está implicada en el reclutamiento y la activación de células dendríticas plasmocitoides productoras de interferón (IFN) de tipo I que aceleran el cierre de la herida al desencadenar la respuesta inflamatoria y proteger de las bacterias patógenas. Esta respuesta temprana de reparación de la herida es independiente de las células T, y está mediada por macrófagos y fibroblastos, que producen los principales factores de crecimiento necesarios para la cicatrización.(8) S. epidermidis se ha visto que está implicado en la cicatrización mediante diferentes vías:
– A través de la señalización TLR-3 (Toll like receptor 3) y mediante la producción de ácido lipoteicoico, puede limitar la inflamación tras la producción de una herida, disminuyendo la liberación de citoquinas proinflamatorias por los queratinocitos, favoreciendo así la transición de la fase de inflamación a la fase de proliferación y, por tanto, promoviendo la cicatrización de la herida. (9)
– Estimula al sistema inmunitario adaptativo, incluidas las células T comensales específicas, que no sólo promueven la protección frente a patógenos, sino que también aceleran el cierre de la herida.
Además, los comensales cutáneos, mediante la citoquina inflamatoria IL-1β, estimulan la producción de péptidos antimicrobianos por los queratinocitos, que protegen al huésped de la invasión de otras bacterias y hongos patógenos. De hecho, la reducción de la microbiota o el uso de antibióticos tópicos se ha mostrado que retrasan la cicatrización.(10)

Entre los estudios realizados sobre microbiota en heridas en humanos, destaca un trabajo que caracterizó el microbioma de heridas agudas (quirúrgicas) en 52 pacientes una semana después de cirugía de Mohs, sin signos ni síntomas de infección. Varias especies bacterianas mostraron diferencias significativas en su cantidad en comparación con la piel control no operada del mismo paciente. La bacteria más común en la piel intacta, Cutibacterium acnes, se redujo 5 veces en las heridas. Sorprendentemente, Staphylococcus aureus, una causa frecuente de infecciones cutáneas postoperatorias, se multiplicó por 6,4 en las heridas clínicamente no infectadas, lo que apoya que la presencia de bacterias patógenas en una herida no es sinónimo de infección. Por último, las bacterias del género Corynebacterium fueron el organismo dominante en las heridas postoperatorias, constituyendo el 37% del microbioma de la herida.(11)
Aunque el tratamiento de las heridas suele basarse en el principio de reducir la carga bacteriana para prevenir las infecciones, el uso indiscriminado de antibióticos tanto tópicos como sistémicos produce resistencias, lo que contribuye a la presión de selección genética para la aparición de infecciones bacterianas multirresistentes y también podría seleccionar tipos de bacterias formadoras de biopelículas que son estructuralmente resistentes a los tratamientos con antibióticos. Además, la simple reducción de la carga bacteriana mediante tratamientos antimicrobianos puede reducir las bacterias beneficiosas, por lo que es importante considerar estrategias alternativas. Las intervenciones dirigidas a restaurar un microbioma equilibrado manteniendo una acción comensal de los microorganismos en el lecho de la herida y disminuyendo la colonización de gérmenes patógenos deberían ser beneficiosas para la cicatrización de heridas.
¿Qué experiencia hay con probióticos en la cicatrización?
Te adelanto que más in vitro que in vivo;)
Aunque los postbióticos (péptidos bacterianos) han cobrado interés más recientemente, la mayoría de los estudios in vivo en heridas se centran en los efectos de los probióticos (bacterias vivas).
El problema a la hora de hacer una revisión de lo publicado en la literatura es que existe una marcada heterogeneidad en cuanto al tipo de herida investigada, el tipo y el régimen de dosificación del probiótico utilizado y la falta de variables resultado estandarizadas.(12)
Varios estudios in vitro han demostrado que los probióticos pueden tener diversas acciones beneficiosas sobre las heridas: inhibiendo los patógenos y la formación de biopelículas, reduciendo el riesgo de infección y acelerando la cicatrización de las heridas. Las bacterias productoras de ácido láctico producen péptidos antiinflamatorios que pueden inhibir la liberación de citoquinas proinflamatorias por los macrófagos.(13)
Se han estudiado los efectos de algunos probióticos como Lactobacillus plantarum, Kefir, Lactobacillus fermentum y Saccharomyces cerevisiae en modelos animales con heridas agudas no infectadas, quemaduras y úlceras venosas. (14,15) Los probióticos tópicos que contienen L. plantarum son los más estudiados in vitro. De hecho, las bacteriocinas (péptidos sintetizados por las bacterias que inhiben el crecimiento de otras cepas) producidas por L. plantarum han demostrado su eficacia contra las biopelículas de S. aureus y los patógenos grampositivos. En quemaduras de 2º y 3er grado, los probióticos tópicos con L. plantarum fueron capaces de reducir la carga bacteriana con la misma eficacia que la sulfadiazina argéntica, sin embargo, no se demostró la relación con la cicatrización de heridas.(16) También hay un estudio con 14 pacientes con úlceras venosas infectadas tratadas con L Plantarum, en las que se halló a los 10 días una disminución de polimorfonucleares y necrosis, así como la reducción de la interleuquina proinflamatoria IL-8.(17)
En resumen, parece que los probióticos actuarían principalmente acortando la fase de inflamación. Los mecanismos de acción por los que los probióticos pueden inducir un efecto antimicrobiano aún no se han dilucidado por completo, pero es probable que sean multifactoriales, con un importante papel de las bacteriocinas.
Mediante ingeniería genética se están diseñando diferentes vehículos para la liberación de los probióticos en las heridas, como el microencapsulado o los hidrogeles.(18) Se han encapsulado microorganismos modificados genéticamente (Lactatus lactis) en hidrogeles, que son polímeros ampliamente utilizados como apósitos en heridas, y se han utilizado en defectos de espesor total en ratas, con una epitelización significativamente más rápida que en el grupo control.(19)
Con respecto al potencial terapéutico de la microbiota sobre las el biofilm, estudios in vitro han demostrado que, en estas biopelículas, se produce un antagonismo entre las especies patógenas y las comensales y que la adición de probióticos a cultivos de bacterias patógenas puede inhibir la formación de biopelículas por parte de bacterias y hongos patógenos en aproximadamente un 50%.
Conclusión:
Un microbioma equilibrado, es decir, diversificado, parece ser relevante para la cicatrización óptima de la herida, ya que limita la proliferación de patógenos, reduciendo el riesgo de infección, inflamación prolongada y cronicidad. Aunque la manipulación del microbioma cutáneo en el campo de la cicatrización todavía está poco explorado, los prometedores resultados de estudios in vitro e in vivo, ponen de relieve su interesante potencial.
Referencias:
- Canchy L, Kerob D, Demessant A, Amici JM. Wound healing and microbiome, an unexpected relationship. J Eur Acad Dermatol Venereol. 2023 Mar;37 Suppl 3:7-15.
- Kunimitsu M, Nakagami G, Minematsu T, Koudounas S, Sanada H. An in vivo critically colonised wound model with dysbiotic wound microbiota. Int Wound J. 2023 Mar;20(3):648-658.
- Tomic-Canic M, Burgess JL, O’Neill KE, Strbo N, Pastar I. Skin microbiota and its interplay with wound healing. Am J Clin Dermatol. 2020;21(Suppl 1):36–43.
- Johnson TR, Gómez BI, McIntyre MK, Dubick MA, Christy RJ, Nicholson SE, et al. The cutaneous microbiome and wounds: new molecular targets to promote wound healing. Int J Mol Sci. 2018;19(9):2699.
- Maheswary T, Nurul AA, Fauzi MB. The insights of microbes’ roles in wound healing: a comprehensive review. Pharmaceutics. 2021;13(7):981.
- Omar A, Wright JB, Schultz G, Burrell R, Nadworny P. Microbial biofilms and chronic wounds. Microorganisms. 2017;5(1):9.
- Smythe P, Wilkinson HN. The Skin Microbiome: Current Landscape and Future Opportunities. Int J Mol Sci. 2023;24(4):3950.
- The commensal skin microbiota triggers type I IFNdependent innate repair responses in injured skin. Nat Immunol. 2020;21(9):1034–45.
- Lai Y, di Nardo A, Nakatsuji T, Leichtle A, Yang Y, Cogen AL, et al. Commensal bacteria regulate toll-like receptor 3-dependent inflammation after skin injury. Nat Med. 2009;15(12):1377–82.
- Wang G, Sweren E, Liu H, Wier E, Alphonse MP, Chen R, et al. Bacteria induce skin regeneration via IL-1beta signaling. Cell Host Microbe. 2021;29(5):777–91.e6.
- Gupta S, Poret AJ, Hashemi D, Eseonu A, Yu SH, D’Gama J, Neel VA, Lieberman TD. Cutaneous Surgical Wounds Have Distinct Microbiomes from Intact Skin. Microbiol Spectr. 2023 Feb 14;11(1):e0330022.11
- Knackstedt R, Knackstedt T, Gatherwright J. The role of topical probiotics on wound healing: a review of animal and human studies. Int Wound J. 2020;17(6):1687–94.
- Saravanan P, R P, Balachander N, K KRS, S S, S R. Anti-inflammatory and wound healing properties of lactic acid bacteria and its peptides [published online ahead of print, 2023 Feb 13] [published correction appears in Folia Microbiol (Praha). 2023 Feb 28;:]. Folia Microbiol (Praha). 2023;1-17.
- Habeebuddin M, Karnati RK, Shiroorkar PN, Nagaraja S, Asdaq SMB, Khalid Anwer M, et al. Topical probiotics: more than a skin deep. Pharmaceutics. 2022;14(3):557.
- Bekiaridou A, Karlafti E, Oikonomou IM, Ioannidis A, Papavramidis TS. Probiotics and their effect on surgical wound healing: a systematic review and new insights into the role of nanotechnology. Nutrients. 2021;13(12):4265.
- Peral MC, Martinez MA, Valdez JC. Bacteriotherapy with Lactobacillus plantarum in burns. Int Wound J. 2009;6(1):73–81.
- Peral MC, Rachid MM, Gobbato NM, Huaman Martinez MA, Valdez JC. Interleukin-8 production by polymorphonuclear leukocytes from patients with chronic infected leg ulcers treated with Lactobacillus plantarum. Clin Microbiol Infect. 2010;16(3):281–6.
- Yang Q, Xue N, Ding X, Tsai KH, Hew JJ, Jiang R, Huang R, Cheng X, Ding X, Yee Cheng Y, Chen J, Wang Y. Role of wound microbiome, strategies of microbiota delivery system and clinical management. Adv Drug Deliv Rev. 2023 Jan;192:114671.
- Li L, Yang C, Ma B, et al. Hydrogel-Encapsulated Engineered Microbial Consortium as a Photoautotrophic «Living Material» for Promoting Skin Wound Healing. ACS Appl Mater Interfaces. 2023;15(5):6536-6547.